INFARTO AGUDO DE MIOCARDIO. MARCADORES BIOQUÍMICO PARA EL DIAGNOSTICO
El infarto agudo del miocardio (IAM) es una de las causas más comunes de morbimortalidad en todo el mundo. Por ello es importante un diagnóstico temprano y exacto para minimizar los daños celulares miocárdicos e instaurar el tratamiento adecuado.
Si bien el ECG es una herramienta indispensable, a menudo resulta insuficiente para
el diagnóstico de un síndrome coronario agudo o de un IAM, La sensibilidad de la elevación del segmento ST para la detección de IAM es de 35 a 50%, y en alrededor de 20% de los casos el ECG es indeterminado y, por lo general, no es muy útil en la detección de microinfartos como los que se pueden manifestar en pacientes con angina de pecho inestable. Por lo tanto, con vistas a potenciar la eficiencia del ECG, es importante contar con herramientas diagnósticas adicionales que sean rápidas y capaces de detectar necrosis miocárdica con alta especificidad y sensibilidad durante las primeras horas de evolución del cuadro isquémico, con la finalidad de decidir oportunamente la conducta terapéutica más adecuada, así como la de estratificar el riesgo futuro en cada paciente.
Cuando se produce el IAM se necrozan las células del tejido miocárdico y pierden la integridad de la membrana celular, esto da lugar a la liberación de enzimas y otras macromoléculas hacia la circulación.
Estas macromoléculas se detectan en la circulación periférica y constituyen los marcadores bioquímicos que permiten establecer el diagnóstico y cuantificación del IAM.
Un marcador ideal de daño miocárdico debe tener las siguientes propiedades:
• cardioespecificidad
• sensibilidad elevada
• capacidad para demostrar un daño irreversible de las fibras musculares miocárdicas y/o debe permitir la detección de un daño mínimo reversible
• debe permitir la determinación de la extensión del daño miocárdico y el pronóstico del paciente
• debe poseer un período de ventana diagnóstica temprana (dentro de 2-6 h) y también tardía (mayor de 7 días)
• debe ser útil para indicar el éxito o, más importante aún, el fallo de la terapia trombolítica en pacientes con IAM
• la medición debe ser rápida (tiempo de análisis de 30 min.), fácil de hacer, cuantitativa y realizable por los servicios de emergencia.
Marcadores de daño miocárdico
La utilización de las enzimas con vistas al diagnóstico de las enfermedades cardiacas ha
sufrido cambios en los últimos años debido al surgimiento de otros marcadores con igual sensibilidad pero mayor especificidad.
Hace algunos años la valoración de algunas enzimas séricas permitía confirmar el diagnóstico clínico presuntivo en el infarto del miocardio agudo o bien se utilizaban como marcadores suplementarios en el seguimiento o evolución del paciente infartado. Actualmente se proponen otras proteínas como marcadores tempranos de daño miocárdico, como son la mioglobina, troponina, isoenzima BB de la glucógeno fosforilasa y otras. Estos marcadores tienen una alta sensibilidad y especificidad y son marcadores de diagnóstico temprano lo que permite hacer la selección de la terapia trombolítica adecuada.
Creatinin Kinasa (CPK): aunque no son específicos del miocardio, durante varias décadas los marcadores bioquímicos empleados para la confirmación del daño miocárdico han sido la CK y su fracción MB. La actividad plasmática de la CPK comienza a elevarse entre las 4 y 8 hs. del comienzo del infarto alcanza un valor máximo entre las 18 y 30 horas y retorna a la normalidad entre las 72 y 96 hs La medición de CK total no es recomendable para el diagnóstico de rutina de IAM debido a que por su amplia distribución tisular, su determinación tiene escasa especificidad y posee un limitado poder pronóstico.
Creatinin Kinasa MB (CPK MB): Isoenzima de la CPK que se encuentra en el músculo cardíaco (y en menor medida en intestino delgado, lengua, diafragma, útero y próstata). Su determinación aumenta la especificidad diagnóstica para IAM comparada con la CPK total. . Las mediciones seriadas de CPK-MB presentan una sensibilidad y una especificidad de alrededor de 92 y 98 % respectivamente, pero la sensibilidad y especificidad de una muestra inicial aislada no se asocia con el mismo valor predictivo. . Aunque la sensibilidad y la especificidad relativas cambian según el momento de presentación después del comienzo de los síntomas, ninguna determinación inicial de un marcador aislado posee el valor predictivo negativo suficiente como para excluir definitivamente el diagnóstico de IAM.
La CK-MB aumenta a las 3 a 6 horas tras el inicio de los síntomas de IAM y el máximo se alcanza entre las 12 y 24 horas.
Como la CK-MB tiene una vida sérica más corta que la CK-MM, el retorno a la normalidad se produce más rápidamente para la CK-MB (de 48 a 72 horas) que para la CK-Total (de 72 a 96 horas).
La CK-MB posee una buena especificidad de órgano, aunque no sea absoluta. Ha sido el marcador de elección para el diagnóstico de IAM durante muchos años.
Las determinaciones repetidas en las primeras horas, tras el inicio de la crisis, permite realizar el diagnóstico de necrosis miocárdica en un plazo muy aceptable, realizando su determinación mediante técnicas inmunológicas. Es muy útil para la monitorización de los pacientes en las Unidades de Medicina Intensiva y Cardiología.
Ante una elevación del nivel de CK-MB, sí el diagnóstico de Isquemia Miocárdica no está claro, es necesario considerar otras patologías que expliquen el origen músculo esquelético del aumento de CK-MB, tales como: traumatismos del músculo esquelético, enfermedades degenerativas e inflamatorias del músculo esquelético, “delirium tremens” (fase aguda del alcoholismo crónico), hipotiroidismo, síndrome de Reye, etc.
La cirugía cardíaca, la miocarditis y la cardioversión eléctrica, cateterización coronaria, anginas de pecho, también elevan a menudo los niveles séricos de la isoenzima MB.
Por todo ello, ha sido necesario desarrollar marcadores bioquímicos cardíacos más específicos.
Una relación Índice de Corte o Índice Relativo:
[(CPK-MB masa / CPK Total) x 100] > 3.5 – 4 %, sugiere un aumento de CK-MB de origen miocárdico, más que esquelético de la CK-MB.
La determinación de la isoenzima CK-MB mediante un método inmunológico y enzimático (técnica de inmunoinhibición), CK MB masa, es ampliamente utilizada debido a su rapidez, sencillez, automatización y bajo costo. Sin embargo, con este método no es raro encontrar, en la práctica diaria, la presencia de falsos positivos que pueden inducir a diagnosticar un infarto agudo de miocardio ante un paciente con dolor torácico y elevación plasmática de esta isoenzima. Las dos causas que con mayor frecuencia interfieren la cuantificación de la isoenzima CK-MB son: la existencia de macrocreatincinasas (macroCK) y la elevación plasmática de la isoenzima CK-BB. En general, ambas suelen manifestarse como aumentos de los valores absolutos (en U/l) o relativos (en porcentaje de actividad de CK) de la isoenzima CK-MB pero respetando las cifras normales de la CK total.
Las macrocreatincinasas (macro-CK) son complejos de isoenzimas de CK que presentan dos características que las definen:
1-su elevado peso molecular (250-350 kDa, respecto a los 80 kDa de la CK)
2-una movilidad electroforética diferente al resto de isoenzimas de CK (CK-MM, CK-MB y CK-BB).
Las técnicas de inmunoinhibición consisten, someramente, en la utilización de anticuerpos monoclonales anti-M que bloquean los monómeros M de las isoenzimas CK-MM y CK-MB, quedando únicamente libre el monómero B de esta última. Este sistema considera implícitamente la no existencia de fracción BB en el suero, lo que ocurre habitualmente en los sujetos sanos. Así, se interpreta la actividad residual de la muestra (tratada con suero anti-M) como procedente exclusivamente del monómero B de la isoenzima CK-MB. Este valor (el 50% de la actividad MB) es duplicado automáticamente obteniéndose así los valores totales de dicha isoenzima.
La presencia de macro-CK o de isoenzima CK-BB interfiere estos resultados, ya que sus actividades enzimáticas no son inhibidas por el suero anti-M y son erróneamente consideradas como procedentes del monómero B de la fracción MB. Además, al duplicarse dichos valores, éstos alcanzan cifras muy elevadas que, paradójicamente, llegan a superar a las de la CK total. En estos casos de aumentos desproporcionados de isoenzima CK-MB, la realización de una electroforesis de isoenzimas de CK, además de confirmar los valores reales de la fracción MB, orienta hacia la causa que interfiere en dichos resultados:
1- macro-CK-1
2- macro-CK-2
3- isoenzima CK-BB
4- elevaciones reales de isoenzima CK-MB de origen no cardiogénico
5- otras situaciones mucho más infrecuentes, como la presencia de la enzima adenilatocinasa.
Láctico deshidrogenasa (LDH): Tras la lesión miocárdica mayor, la actividad de la LDH sérica aumenta menos rápidamente que la actividad de CK Total, o la de la CK-MB.
Comienza a elevarse a las 12 16 horas desde el inicio de los síntomas que exteriorizan el Daño Miocárdico. Alcanza su máximo a las 30 a 40 horas. Permanece elevada durante 10 a 12 días.
Por ello, es particularmente útil para el diagnóstico tardío, cuando el paciente es visitado suficiente tiempo después para que la CPK Total y la AST sean normales.
La Troponina I, permanece elevada en suero, después del Daño Miocárdico, durante 7 a 9 días. La Troponina T, permanece elevada en suero, después del Daño Miocárdico, durante 10 a 14 días. Es decir, si se utiliza la Troponina T, no hará falta emplear la LDH. Si se utiliza la Troponina I, si hará falta emplear la LDH, para diagnosticar Síndromes Coronarios de un modo tardío.
En suero normal, la LD2 es mayor que la LD1 y el cociente LD1/LD2 es inferior a 1.
Tras Necrosis Miocárdica, la proporción de LD1 aumenta en comparación con las otras isoenzimas y el cociente LD1/LD2 es superior a 1 (LD invertida).
Troponinas: constituyen un complejo de proteínas estructurales y regulatorias del músculo cardíaco y esquelético. Consiste de tres subunidades: Troponina T, Troponina I y Troponina C. Las troponinas TnT y TnI están presentes en el músculo esquelético y cardíaco, sin embargo por ser codificadas por diferentes genes y tener diferente secuencia de aminoácidos producen anticuerpos diferentes que permiten ser detectados independientemente.
Los niveles séricos de troponinas son habitualmente muy bajos y resultan indetectables. Por lo tanto son altamente sensibles y específicas, siendo capaz de detectar incluso, zonas microscópicas de infarto de miocardio
Las Troponinas inician su elevación a las 3 a 7 horas de producido el evento y se mantienen por encima de los valores normales de 7 a 14 días, pudiendo servir estas para un diagnóstico retrospectivo.
Resultados falsos positivos, han sido observados en la Troponina T en pacientes en situación de Insuficiencia Renal Terminal, sometidos a diálisis.
La determinación de Troponina I Cardíaca puede ser útil para descartar la existencia de Daño Miocárdico cuando hay afectación músculo – esquelética que pueda elevar la CK Total y la CK-MB (Cardioversión, Resucitación Cardiopulmonar, etc.).
En general e prefiere la TnI y no la TnT porque esta última se expresa en otros músculos aparte del corazón pero la Troponina T es muy útil, si no disponemos de la Troponina I.
Mioglobina: La mioglobina es el primer marcador que se eleva después del daño celular miocárdico. La descripción de que la mioglobina se eleva durante los episodios de cardiopatía isquémica se realizó desde la década de los 70. La mioglobina es una proteína compuesta por una cadena polipeptídica y un grupo prostético Hemo que está presente en todas las fibras del músculo estriado, y cerca de 2% se encuentra en tejido de masa cardiaca y esquelética, pero está ausente en el músculo liso. La función principal de la mioglobina es transportar oxígeno de la membrana reservorio de oxígeno en el músculo Debido a que se trata de una molécula de poco peso molecular (17,800 D), la mioglobina «escapa» rápidamente hacia la célula miocárdica demandante, ésta puede ser detectada 2 horas después de ocurrido el infarto, con nivel sérico «pico» entre 3 a 15 horas. Su sensibilidad al momento de la presentación del evento es de 49%
y su especificidad de 91%. Sin embargo, este marcador presenta ciertas desventajas:
a) Debido a que tanto el músculo cardiaco y esquelético contienen mioglobina, muchos factores no cardiacos, tales como desórdenes neuromusculares o de músculo esquelético, ejercicio extremo, falla renal, inyecciones intramusculares, así como cirugía de revascularización cardiaca, pueden elevar esta proteína.
b) Factores adicionales como son raza, sexo y edad (aumentan con la edad) también pueden afectar los niveles normales de mioglobina.
c) Existe controversia sobre el nivel de referencia que varía de 50 a 120 μg/ml de mioglobina como indicador de IAM.
Las muestras seriadas mejoran la capacidad diagnóstica. La especificidad de la mioglobina en el diagnóstico de IAM puede incrementarse mediante el monitoreo con un marcador adicional como la anhidrasa carbónica III
Relación Mioglobina Anhidrasa Carbónica: En los pacientes que sufren un infarto agudo de miocardio, la mioglobina se eleva en un porcentaje de pacientes similar al porcentaje en los que se elevan la troponina cardíaca o la CK. Pero, a diferencia de estos marcadores, que presentan una elevación tardía en el plasma (pueden no detectarse su elevación hasta pasadas incluso 12 horas del comienzo de los síntomas) la mioglobina aumenta su concentración plasmática de una forma muy precoz. Sin embargo, siempre se debe tener en cuenta que existen dos importantes limitaciones cuando se utiliza la mioglobina como test diagnóstico para el infarto agudo de miocardio:
a) La rápida liberación y metabolización de la hemoglobina puede producir patrones de concentraciones ascendentes y descendentes en muy cortos períodos de tiempo lo que puede conducir a una confusión en la interpretación clínica de los resultados y
b) presenta una muy baja especificidad por el corazón; se pueden detectar niveles elevados de mioglobina tras la lesión de numerosos tejidos, especialmente el músculo esquelético o tras el uso de cocaína o en pacientes con insuficiencia renal y un clearence de creatinina deprimido. Se ha intentado mejorar la especificidad de la medición de mioglobina mediante la determinación simultánea de anhidrasa carbónica III, otra proteína del músculo esquelético muy escasamente presente en el músculo cardíaco. De esa forma, elevaciones de mioglobina en el plasma sin una elevación asociada de anhidrasa carbónica III sugerirían que el músculo dañado es el cardíaco y no el esquelético
PCR ultrasensible: es un marcador de inflamación sistémica y como tal resulta útil para establecer el pronóstico de los pacientes con Síndrome coronario agudo. Parece ser una herramienta muy útil para la valoración de Riesgo Cardiovascular. Su determinación permitiría seleccionar el tipo de tratamiento médico más eficaz, la utilización de una estrategia invasiva o conservadora, y la decisión de revascularizar o no al paciente. Como es inespecífica (aumenta en enfermedades inflamatorias), se recomienda tomar dos medidas con una diferencia de dos semanas, para determinar el rango. En prevención secundaria predice riesgo de volver a sufrir otro evento. Estudios prospectivos realizados en varones aparentemente sanos, particularmente con niveles de lípidos bajos y/o con factores de riesgo coronario alto o bajo, indican que los niveles elevados de PCR de alta sensibilidad proporcionan un valor pronóstico a corto y largo plazo de: presentación del primer IAM, morbi-mortalidad debido al daño de la célula miocárdica asociada a enfermedad coronaria, muerte súbita por causas cardiacas, enfermedad arterial periférica o de la activación del sistema hemostático. Sin embargo, los mecanismos precisos de asociación entre niveles de PCR y estos eventos adversos no han sido descritos completamente. Teóricamente, el descenso de los niveles de lipoproteínas aterogénicas puede reducir la inflamación sistémica, y por tanto reduce los niveles de PCR.
De acuerdo con la American Heart Association (Asociación Estadounidense de Cardiología), el riesgo de desarrollar enfermedad cardiovascular está relacionado con los siguientes rangos en los valores de PCR ultrasensible:
-Bajo riesgo de desarrollar enfermedad cardiovascular si el nivel de PCR de alta sensibilidad está por debajo de 1.0 mg/L.
Riesgo moderado de sufrir enfermedad cardiovascular si los niveles están entre 1.0 y 3.0 mg/L.
Alto riesgo de desarrollar enfermedad cardiovascular si el nivel de PCR de alta sensibilidad está por encima de 3.0 mg/L.
Proteínas de unión de ácidos grasos (FABP): Proteínas citosólicas muy abundantes, de bajo peso molecular de14,000 a 15,000 D cuyo papel es el transporte intracelular de ácidos grasos. Tres FABPs diferentes se encuentran en corazón, hígado e intestino; también se encuentran en otros tejidos para la utilización de los ácidos grasos como sustratos metabólicos. FABP cardiacas poseen una estructura única y son abundantes en el miocardio, pero también pueden detectarse en músculo cardiaco y riñones. La cinética en el plasma de los FABP se asemeja a los de la mioglobina ya que se encuentran niveles elevados en suero después de las dos horas posteriores al infarto
de miocardio y vuelven a la normalidad entre las 18 a 24 horas posteriores al IAM Pero la concentración de FABP en el músculo esquelético es 20 veces menor que en el tejido cardíaco . Esto hace que FABP sea un marcador bioquímico útil para la evaluación temprana o la exclusión de IAM. También parece ser un marcador de plasma útil para la estimación del tamaño del infarto de miocardio.
Las mediciones de estas proteínas pueden tener una sensibilidad comparada a la de mioglobina para la detección de reperfusión después de terapia trombolítica
Copeptina: Es un fragmento del precursor de la Vasopresina (Pre-pro-vasopresina), perece ser un importante predictor de mortalidad en los pacientes portadores de Insuficiencia cardiaca. Es sintetizada y secretada en forma equivalente a la vasopresina, y si bien ambas tienen una corta vida in vivo, la copeptina tiene una mucho mayor estabilidad in Vitro.
Según estudios realizados, la copeptina demostró ser el más potente predictor de mortalidad a los 24 meses en los pacientes con IC, especialmente aquellos con síntomas leves o moderados, que son más difíciles de evaluar en forma ambulatoria, lo que la transforma en una nueva herramienta de trabajo, con la idea de elegir a los pacientes que se podrían beneficiar de un tratamiento con drogas antagonistas de los receptores renales de la Vasopresina.
Glucógeno fosforilasa: La glucógeno-fosforilasa (EC 2.4.1.1) es una enzima dimérica que desempeña un papel esencial en la regulación del metabolismo de los carbohidratos a través de la movilización del glucógeno. Existen tres isoenzimas diferentes en los tejidos humanos: LL (hígado), MM (músculo) y BB (cerebro). Estas isoenzimas recibieron su nombre por el tejido donde primero fueron encontradas y preferiblemente expresadas. Estas tres isoenzimas son codificadas por genes diferentes y también pueden ser diferenciadas por sus propiedades funcionales e inmunológicas. La isoforma BB es la que predomina en el corazón, pero a concentraciones tisulares similares a las encontradas en el cerebro. También se han reportado concentraciones menores en los leucocitos, las plaquetas, el bazo, los riñones, la vesícula, los testículos, el tracto digestivo y la arteria aorta. La glucógeno-fosforilasa se expresa en el músculo esquelético de la rata en el período fetal, al igual que en los humanos, pero no se han realizado investigaciones suficientes en este sentido. Por lo tanto, con esta enzima pudiera suceder lo mismo que con la TnT y la CKMB; puede expresarse en el músculo esquelético estimulado crónicamente y con ello perder su cardioespecificidad.
Péptidos natriuréticos: Los péptidos natriuréticos juegan un papel importante en la homeostasis y enfermedad cardiovascular. La familia de los péptidos natriuréticos de los mamíferos comprende: péptido natriurético atrial (PAN ó ANP), péptido natriurético cerebral (PNC ó BNP), péptido natriurético tipo C (CNP), péptido natriurético dendroaspis (DNP) y urodilatina.
Péptido natriurético cerebral BNP es producido en los miocitos atriales y ventriculares.
Es depositado junto al ANP en gránulos de depósito en miocitos y su liberación es regulada a nivel de la expresión genética.
Es sintetizado como un pre-pro-BNP y luego procesado intracelularmente a pro-BNP y secretado en forma inactiva como N-BNP (extremo amino) y forma activa C-BNP (extremo carboxilo). El estímulo predominante para su liberación es el aumento de estrés de la pared; se secreta en respuesta al aumento de la volemia y a problema fisiopatológicos cardíacos. Se libera de los miocitos ventriculares al aumentar la presión de la pared ventricular, por eso es un marcador muy sensible de disfunción ventricular izquierda
Su utilidades diagnóstica se basa en que aumenta en insuficiencia cardíaca y se eleva precoz y proporcionalmente al grado de insuficiencia, también en pacientes con IAM y disfunción ventricular. Es útil como screening, diagnóstico, manejo clínico y pronóstico de problemas cardíacos.
En IAM su pico se correlaciona con el pico de la CPK total y con el tamaño del infarto su concentración en la fase aguda del infarto es un predictor independiente de supervivenica a largo término postinfarto, esto quiere decir que en pacientes con altas concentraciones deberían ser investigados por posibles enfermedades cardiovasculares.
Si existe resolución de la enfermedad o tratamiento adecuado, su concentración va disminuyendo.
Si aumenta en forma moderada, hay falta de especificidad cardíaca, ya que aumenta en otras patologías también: fallo renal, EPOC.
Se cuantifica en plasma, tiene mayor cantidad discriminante y no está sujeto a ningún ritmo circadiano.
El uso de inhibidores de la ECA (Enzima convertidora de angiotensina) y beta bloqueantes reduce la concentración del pro-BNP y por lo tanto su valor predictivo.
Conclusión
La Nacional Academy of Clinical Biochemistry (NACB) y la International Federation of Clinical Chemistry and Laboratory Medicine (IFCC) establecieron recomendaciones sobre el empleo de los parámetros bioquímicos en la enfermedad coronaria. Tanto la NACB como la IFCC recomiendan el uso de dos marcadores (uno temprano y uno tardío) para el diagnóstico de IAM. Como temprano recomiendan la determinación de mioglobina, que aumenta dentro de las 2 horas del dolor de pecho y la concentración de la CK-MB masa que incrementa su valor dentro de las 6 horas de producido el evento. Si bien la mioglobina posee pobre especificidad diagnóstica, tiene alto valor predictivo negativo. Y como diagnóstico definitivo de IAM, la troponina (T o I) que permanece elevada durante 4 a 10 días. En función de estas recomendaciones se incluyen en el perfil cardíaco del laboratorio estas tres determinaciones.
Cada vez que se introducen nuevos analitos, se deberá verificar si los intervalos de referencia (IR) del fabricante coinciden con la población con la cual se trabaja. Esto permitirá que los resultados emitidos sean comparados con un IR confiable, al momento de decidir frente a un valor determinado si se está en presencia o no de enfermedad.
Cada laboratorio deberá establecer sus propios IR para garantizar la representación adecuada de poblaciones especificas y tipos de muestra.
Para que estos parámetros bioquímicos puedan ser usados en el diagnóstico de una enfermedad coronaria, el laboratorio deberá emitir un informe en un tiempo de respuesta igual a 1 hora. Además, la determinación deberá tener un coeficiente de variación menor de 10%, tanto en los valores discriminantes bajos como en el punto de corte del IAM. Si bien se recomienda el uso de plasma como espécimen ideal, puede realizarse con muestras de suero si no se dispone tubos con heparina de litio.
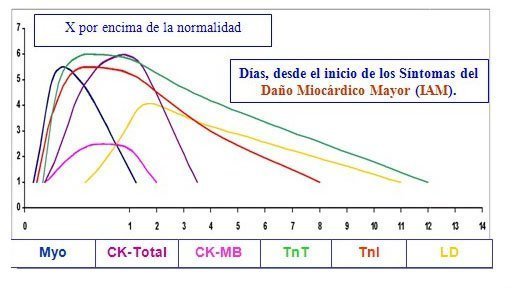
Myo: mioglobina LD: láctico deshidrogenasa
Artículo escrito por:
María Alejandra Quesada
Licenciada en Bioquímica
Bibliografía
Early Diagnosis of Myocardial Infarction with Sensitive Cardiac Troponin Assay. .Tobias Reichlin, M.D., Willibald Hochholzer, M.D., Stefano Bassetti, M.D. ,The New England Journal o f Medicine.
Evaluation of the patient with acute chest pain. Thomas H. Lee, MD; and Lee Goldman, MD
Troponin T levels in patients with acute coronary syndromes,with or without renal dysfunction. Ronnier J.A Viles ,M.D., Arman T. Askari, M.D. ,Bertil Lindahl , M.D., Ph D., Lars Wallentin M.D.,Pph.D,
Incremental Value of Copeptin for Rapid Rule Out of Acute Myocardial Infarction. Tobias Reichlin MD , Willibald Hochholzer MD , Claudia Stelzig MSc , Journal of the American College of Cardiology. 2009. 54, 60-68
Acerca de la Redefinición del Infarto Agudo de Miocardio. Guillermo Grau Jornet..Médico. Especialista en Cardiología .Hospital “Virgen de los Lirios”. Alcoy. Alicante. España.
Marcadores séricos bioquímicos cardíacos .J. I. A. Soler Díaz, M. Garrido Fernández, R. Navarro Castelló, J. Díaz Torres.
Nuevos criterios de diagnóstico de infarto de miocardio: orden en el caos. José López-Sendón y Esteban López de Sá. Unidad Coronaria. Hospital Universitario Gregorio Marañón. Madrid.
Utilidad clínica de los distintos marcadores biológicos CPK,CPK MB masa, mioglobina y troponina T en una unidadde dolor torácico. ¿Cuándo, cuáles y cómo pedirlos?
Javier Fernández Portales, José A. García Robles, Javier Jiménez Candil, Esther Pérez David,
Servicio de Cardiología. Hospital General Universitario Gregorio Marañón. Madrid. España.
Marcadores séricos en los síndromes coronarios agudos. Gerardo O. Zapata
Jefe de Unidad Coronaria. Instituto Cardiovascular de Rosario.
Marcadores cardiacos. Resumen de esta “Guía Práctica” y Conclusiones. Redefinición del infarto agudo de miocardio (IAM) y Angina de Pecho en Síndrome Coronario Agudo (SCA).
J. I. A. Soler Díaz, M. Garrido Fernández, F. Bornay Llinares, R. Navarro Castelló, J. C. Latorre Martínez, V. Priego Martínez.
Síndrome coronario agudo: Marcadores de lesión miocárdica. José Roberto Barba Evia. Jefe de la División de Auxiliares de Diagnóstico de la Unidad Médica deAlta Especialidad No. 25. Mérida Yucatán. Instituto Mexicano del Seguro Social.
Cinética de la proteína C reactiva en las distintas manifestaciones clínicas del síndrome coronario agudo. Pedro L. Sáncheza, María V. Rodríguezb, Eduardo Villacortaa, Carmen Albarránc. Instituto de Ciencias del Corazón (ICICOR). Hospital Clínico Universitario de Valladolid. Valladolid. España.Servicio de Bioquímica. Hospital Universitario de Salamanca. Salamanca. España. Servicio de Cardiología. Hospital Universitario de Salamanca. Salamanca. España.
Sensitive Troponin I Assay in Early Diagnosis of Acute Myocardial Infarction. Till Keller, M.D., Tanja Zeller, Ph.D., Dirk Peetz, M.D., Stergios Tzikas, M.D., y otros. The New England Journal o f Medicine.

